-
Giỏ hàng của bạn trống!
Máy quang phổ đo màu sắc
Giá bán : Liên hệ
Máy quang phổ là gì?
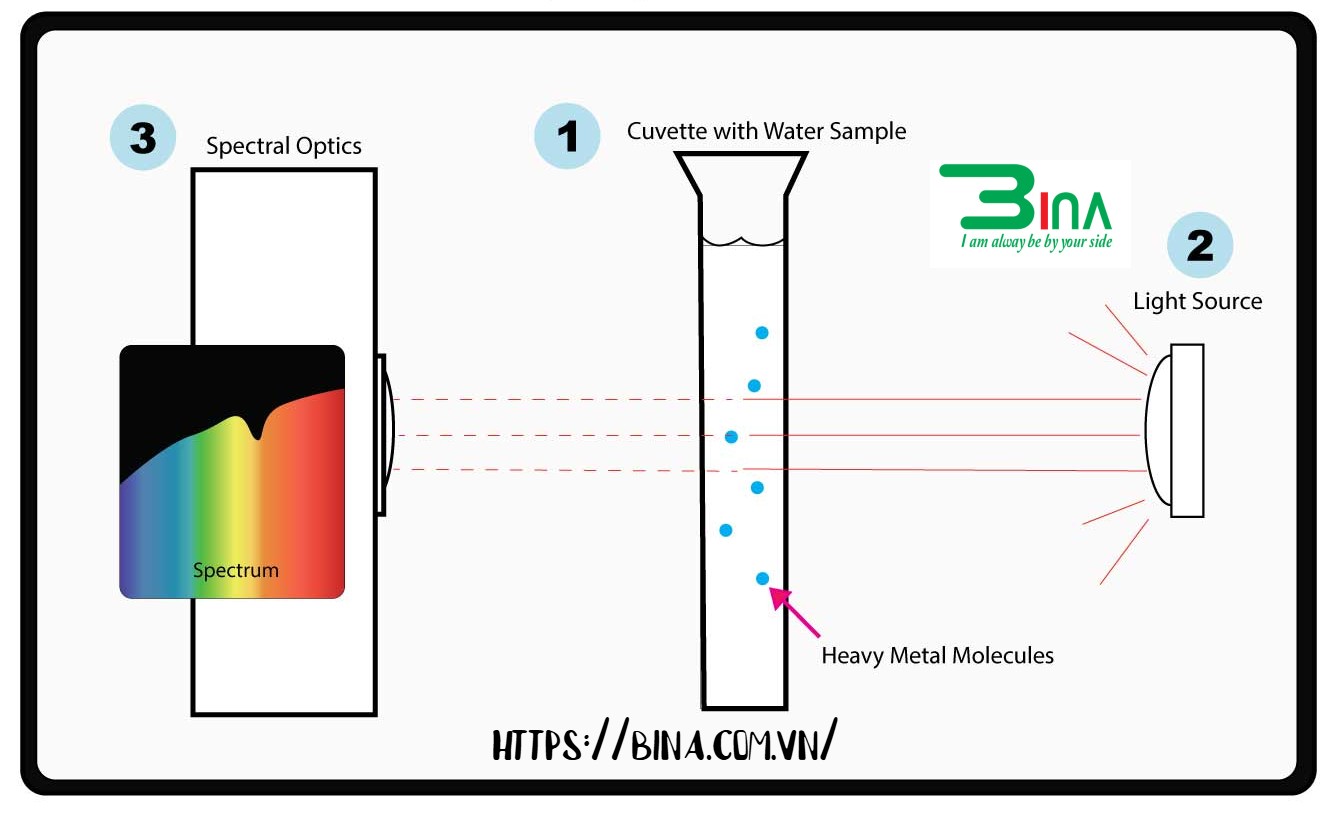
Máy quang phổ, còn được gọi là máy quang phổ, là một thiết bị khoa học phân tích ánh sáng phức tạp thành các vạch quang phổ. Phạm vi đo của nó thường bao gồm vùng ánh sáng khả kiến (380–780 nm) và vùng ánh sáng cực tím (200–380 nm). Các nguồn sáng khác nhau có phổ phát xạ riêng, do đó các vật phát sáng khác nhau có thể được sử dụng làm nguồn sáng của thiết bị. Phổ phát xạ của đèn vonfram: Ánh sáng quang phổ phát ra từ đèn vonfram có bước sóng 380–780 nm, sau khi bị khúc xạ bởi lăng kính, tạo ra quang phổ liên tục gồm đỏ, cam, vàng, lục, lam, chàm và tím; quang phổ này có thể được sử dụng làm nguồn sáng cho máy quang phổ ánh sáng khả kiến.
 |
➢Xem thêm: https://bina.com.vn/san-pham/may-kho-nhiet/
Giới thiệu về máy quang phổ
Phép quang phổ là một phương pháp phân tích định tính hoặc định lượng một chất bằng cách đo độ hấp thụ ánh sáng ở một bước sóng cụ thể hoặc trong một dải bước sóng nhất định. Các dải bước sóng thường được sử dụng là: (1) vùng tử ngoại từ 200–380 nm, (2) vùng khả kiến từ 380–780 nm, và (3) vùng hồng ngoại từ 2,5–25 μm (4000 cm⁻¹–400 cm⁻¹ về số sóng). Các thiết bị được sử dụng là máy quang phổ tử ngoại, máy quang phổ khả kiến (hoặc máy đo màu), máy quang phổ hồng ngoại hoặc máy quang phổ hấp thụ nguyên tử. Để đảm bảo độ chính xác và độ tin cậy của phép đo, tất cả các thiết bị cần được hiệu chuẩn và kiểm định định kỳ theo quy định kiểm định đo lường quốc gia hoặc các quy định trong phụ lục này.
 |
Thành phần thiết bị:
Máy quang phổ đã trở thành thiết bị thường quy trong các phòng thí nghiệm sinh học phân tử hiện đại. Chúng thường được sử dụng để định lượng axit nucleic, protein và nồng độ tăng trưởng của vi khuẩn.
Thiết bị chủ yếu bao gồm nguồn sáng, máy đơn sắc, buồng mẫu, đầu dò, bộ xử lý tín hiệu, hệ thống hiển thị và lưu trữ. Dải quang phổ bao gồm vùng ánh sáng khả kiến có bước sóng từ 400 đến 760 nm và vùng ánh sáng cực tím có bước sóng từ 200 đến 400 nm. Các nguồn sáng khác nhau có phổ phát xạ riêng, do đó có thể sử dụng các bộ phát sáng khác nhau làm nguồn sáng cho thiết bị.
- ✓Phổ phát xạ của đèn vonfram: Ánh sáng quang phổ phát ra từ đèn vonfram có bước sóng từ 400 đến 760 nm, sau khi bị khúc xạ bởi lăng kính, tạo ra quang phổ liên tục bao gồm đỏ-cam, vàng-lục, lam-chàm và tím; quang phổ này có thể được sử dụng làm nguồn sáng cho máy quang phổ ánh sáng khả kiến.
- ✓Phổ phát xạ của đèn hydro (hay đèn deuterium): Đèn hydro phát ra quang phổ có bước sóng từ 185–400 nm và có thể được sử dụng làm nguồn sáng cho máy quang phổ tử ngoại.
- ✓Phổ hấp thụ của các chất: Nếu đặt dung dịch của một chất giữa nguồn sáng và lăng kính, quang phổ hiển thị trên màn hình không còn là quang phổ của nguồn sáng nữa; một số vạch tối xuất hiện. Điều này có nghĩa là một số bước sóng ánh sáng nhất định trong quang phổ phát xạ của nguồn sáng bị biến mất do bị dung dịch hấp thụ. Quang phổ này sau khi bị dung dịch hấp thụ được gọi là quang phổ hấp thụ của dung dịch đó.
Các chất khác nhau có quang phổ hấp thụ khác nhau. Do đó, các chất có trong dung dịch có thể được xác định dựa trên quang phổ hấp thụ.
Khi ánh sáng đi qua dung dịch của một chất, cường độ ánh sáng truyền qua giảm do một phần ánh sáng bị phản xạ hoặc tán xạ trên bề mặt dung dịch, một phần ánh sáng bị hấp thụ bởi các chất tạo nên dung dịch, và chỉ một phần ánh sáng có thể đi qua dung dịch.
Ánh sáng tới = Ánh sáng phản xạ + Ánh sáng tán xạ + Ánh sáng hấp thụ + Ánh sáng truyền qua.
Nếu chúng ta sử dụng nước cất (hoặc dung môi tạo nên dung dịch này) làm “dung dịch trắng” để hiệu chỉnh sự mất mát ánh sáng tới do phản xạ, tán xạ, v.v., thì: Ánh sáng tới = Ánh sáng hấp thụ + Ánh sáng truyền qua.
 |
Nguyên lý:
Máy quang phổ sử dụng nguồn sáng có thể tạo ra nhiều bước sóng. Thông qua một loạt các thiết bị quang phổ, một nguồn sáng có bước sóng cụ thể được tạo ra. Sau khi ánh sáng đi qua mẫu cần kiểm tra, một phần ánh sáng bị hấp thụ. Giá trị hấp thụ của mẫu được tính toán và do đó được chuyển đổi thành nồng độ mẫu. Giá trị hấp thụ của mẫu tỷ lệ thuận với nồng độ mẫu.
Khi bức xạ ánh sáng đơn sắc đi qua dung dịch của một chất cần phân tích, lượng chất đó hấp thụ tỷ lệ thuận với nồng độ của chất đó và độ dày của lớp chất lỏng (chiều dài đường quang), như thể hiện trong công thức sau:
A = -lg(I/I0) = -lgT = kLc
Trong đó:
- ✓A là độ hấp thụ;
- ✓I0 là cường độ ánh sáng đơn sắc tới;
- ✓I là cường độ ánh sáng đơn sắc truyền qua;
- ✓T là độ truyền qua của chất;
- ✓k là độ hấp thụ mol;
- ✓L là chiều dài đường quang của chất phân tích, tức là chiều dài cạnh của cuvet;
- ✓c là nồng độ của chất;
Bước sóng hấp thụ chọn lọc của một chất và hệ số hấp thụ tương ứng là các hằng số vật lý của chất đó. Khi đã biết hệ số hấp thụ của một chất tinh khiết trong một điều kiện nhất định, mẫu có thể được pha thành dung dịch trong cùng điều kiện và có thể đo độ hấp thụ của nó. Hàm lượng chất trong mẫu sau đó có thể được tính toán bằng công thức trên. Trong vùng ánh sáng khả kiến, bên cạnh một số chất hấp thụ ánh sáng, nhiều chất không tự hấp thụ ánh sáng mà có thể được nhuộm màu bằng cách thêm thuốc thử so màu hoặc xử lý trong một số điều kiện nhất định trước khi đo; do đó, phương pháp này còn được gọi là phân tích so màu. Do nhiều yếu tố ảnh hưởng đến độ sâu phát triển màu sắc và các thiết bị thường sử dụng có độ tinh khiết ánh sáng đơn sắc thấp hơn, nên cần sử dụng đồng thời các chuẩn hoặc chuẩn tham chiếu trong quá trình đo.
 |
Tính năng của thiết bị:
Hệ thống quang học chùm tia kép, đường dẫn kép độc đáo mang lại độ phân giải cao hơn, giảm ánh sáng lạc, tăng cường độ ổn định và độ tin cậy, đồng thời phân tích chính xác hơn; Màn hình LCD 6 inch độ sáng cao, ma trận điểm 320*240 cung cấp thông tin rõ ràng và đầy đủ; Thiết kế đường dẫn quang dài độc đáo giúp tăng cường độ phân giải, đặc biệt phù hợp cho việc kiểm tra thể tích vết. Khả năng xử lý dữ liệu mạnh mẽ đảm bảo ứng dụng toàn diện kết quả kiểm tra, giúp người dùng chỉnh sửa đơn giản và nhanh chóng hơn. Thiết kế hệ thống quang treo với đế nhôm dày 16mm cố định độc lập, không bị biến dạng, loại bỏ tác động của biến dạng tấm đế và rung động bên ngoài lên hệ thống quang học, do đó cải thiện đáng kể độ ổn định và độ tin cậy của thiết bị. Cơ chế sóng sin đồng bộ đảm bảo độ chính xác và khả năng lặp lại bước sóng cao. Hệ thống ARM được sử dụng. Sáu băng thông phổ (0,1/0,2/0,5/1,0/2,0/4,0) có thể tự động lựa chọn để đáp ứng nhu cầu đo lường của người dùng khác nhau. Bộ chuyển đổi A/D tốc độ cao, độ chính xác cao 24 bit mang lại độ chính xác cao hơn và phản hồi nhanh hơn. Các linh kiện chính được nhập khẩu, đảm bảo hiệu suất cao. Thiết bị có độ nhiễu ánh sáng thấp hơn, độ ổn định được cải thiện và độ tin cậy cao hơn.
Thiết bị sở hữu nhiều chức năng mạnh mẽ hơn, với bộ phận chính có khả năng hoạt động độc lập Đo quang trắc, đo định lượng, quét phổ, phân tích động học, xét nghiệm DNA/protein, xét nghiệm đa bước sóng và in dữ liệu.
Dựa trên thói quen sử dụng của nhiều người dùng khác nhau, dòng thiết bị này được trang bị sẵn phần mềm quét quang phổ của Yuanxi. Khi hoạt động trực tuyến, ngoài việc thực hiện tất cả các chức năng kiểm tra của thiết bị chính, nó còn cho phép xử lý dữ liệu mạnh mẽ hơn và lưu trữ dữ liệu không giới hạn.
 |
Thông số kỹ thuật thiết bị:
- ✓Model UV-9000;
- ✓Dải bước sóng 190-900nm;
- ✓Băng thông phổ 0,1/0,2/0,5/1,0/2,0/4,0nm (sáu bước sóng có thể lựa chọn); Độ chính xác ±0,1nm (D2). 656,1nm), ±0,3nm;
- ✓Độ lặp lại bước sóng toàn diện ≤0,1nm.
- ✓Độ chính xác quang trắc: ±0,2%T
- ✓Độ lặp lại quang trắc: ≤0,1%T
- ✓Ánh sáng lạc: ≤0,01%T
- ✓Độ ổn định: ±0,0004A/h (ở 500nm)
- ✓Độ phẳng đường nền: ±0,001A
- ✓Độ nhiễu: ±0,0004A/h
- ✓Dải đo quang: 0-200%T
- ✓Nguồn điện: AC 220V/50Hz hoặc 110V/60Hz
- ✓Trọng lượng: 30kg
- ✓Thông số kỹ thuật:
- ✓Dải bước sóng: 320–1000nm
- ✓Băng thông phổ: 4nm
- ✓Ánh sáng lạc: ≤0,5% (ở 360nm)
- ✓Độ chính xác bước sóng: Tốt hơn ±2nm
- ✓Độ chính xác truyền qua: ≤±1nmT
Ứng dụng phổ biến
Định lượng Axit Nucleic
Định lượng axit nucleic là chức năng được sử dụng phổ biến nhất của máy quang phổ. Máy có thể định lượng oligonucleotide, chuỗi đơn và DNA mạch kép và RNA hòa tan trong dung dịch đệm. Bước sóng hấp thụ của đỉnh hấp thụ cao nhất của axit nucleic là 260 nm. Mỗi axit nucleic có cấu trúc phân tử khác nhau, do đó hệ số chuyển đổi của nó cũng khác nhau. Để định lượng các loại axit nucleic khác nhau, cần phải chọn trước hệ số tương ứng. Ví dụ: 1OD. Các giá trị hấp thụ tương ứng với 50 μg/ml dsDNA, 37 μg/ml ssDNA, 40 μg/ml RNA và 30 μg/ml Oligo. Sau khi chuyển đổi bằng các hệ số đã đề cập ở trên, nồng độ mẫu tương ứng sẽ thu được từ các giá trị hấp thụ đo được. Trước khi thử nghiệm, chương trình chính xác được chọn và thể tích dung dịch gốc và dung dịch pha loãng được nhập vào. Sau đó, dung dịch trắng và dung dịch mẫu được thử nghiệm. Tuy nhiên, các thí nghiệm không phải lúc nào cũng diễn ra suôn sẻ. Các kết quả đo không ổn định có lẽ là vấn đề khó khăn nhất đối với người thực hiện thí nghiệm. Độ nhạy của thiết bị càng cao thì độ lệch của giá trị hấp thụ càng lớn.
Trên thực tế, thiết kế và nguyên lý hoạt động của máy quang phổ cho phép các giá trị độ hấp thụ thay đổi trong một phạm vi nhất định; nghĩa là, thiết bị có một mức độ chính xác và độ chính xác nhất định. Ví dụ, Eppendorf… Độ chính xác của máy quang phổ sinh học là ≤1,0% (1A). Do đó, việc nhiều kết quả thử nghiệm dao động trong phạm vi khoảng 1,0% là bình thường. Ngoài ra, cần xem xét các đặc tính lý hóa của chính axit nucleic, độ pH và nồng độ ion của dung dịch đệm được sử dụng để hòa tan axit nucleic. Nồng độ ion quá cao có thể gây ra hiện tượng trôi kết quả đọc, chẳng hạn như TE, có thể làm ổn định đáng kể kết quả đọc. Pha loãng mẫu cũng là một yếu tố quan trọng: các hạt nhỏ là không thể tránh khỏi trong mẫu, đặc biệt là mẫu axit nucleic. Những hạt này ảnh hưởng đến kết quả thử nghiệm. Để giảm thiểu tác động của các hạt đến kết quả thử nghiệm, độ hấp thụ axit nucleic phải lớn hơn ít nhất 0,1A, lý tưởng nhất là từ 0,1 đến 1A. 5A. Trong phạm vi này, hỗn hợp phải không có bọt khí và dung dịch trắng phải không có chất lơ lửng; nếu không, kết quả đọc sẽ trôi rất nhanh. Phải sử dụng cùng một cuvet để kiểm tra cả dung dịch trắng và mẫu; nếu không, sự chênh lệch nồng độ sẽ quá lớn. Hệ số chuyển đổi và đơn vị nồng độ mẫu phải nhất quán. Không được sử dụng cuvet có cửa sổ bị mòn. Thể tích mẫu phải đáp ứng thể tích tối thiểu mà cuvet yêu cầu, cùng với các cân nhắc vận hành khác.
Bên cạnh nồng độ axit nucleic, máy quang phổ còn hiển thị một số tỷ lệ rất quan trọng biểu thị độ tinh khiết của mẫu, chẳng hạn như tỷ lệ A260/A280, được sử dụng để đánh giá độ tinh khiết của mẫu vì đỉnh hấp thụ của protein nằm ở 280 nm. Đối với mẫu tinh khiết, tỷ lệ này lớn hơn 1,8 (DNA) hoặc 2,0 (RNA). Nếu tỷ lệ này thấp hơn 1,8 hoặc 2,0, điều đó cho thấy sự hiện diện của protein hoặc các hợp chất phenolic. A230 biểu thị sự hiện diện của một số chất gây ô nhiễm trong mẫu, chẳng hạn như carbohydrate, peptide, phenol, v.v. Đối với axit nucleic tương đối tinh khiết, tỷ lệ A260/A230 lớn hơn 2,0. A320 phát hiện độ đục của dung dịch và các yếu tố gây nhiễu khác. Đối với mẫu tinh khiết, A320 thường là 0.
 |
Định lượng Protein trực tiếp (Phương pháp UV)
Phương pháp này kiểm tra trực tiếp protein ở bước sóng 280 nm. Sử dụng công thức Warburg, máy quang phổ có thể hiển thị trực tiếp nồng độ mẫu, hoặc có thể chọn phương pháp chuyển đổi tương ứng để chuyển đổi giá trị hấp thụ sang nồng độ mẫu. Quy trình định lượng protein rất đơn giản: trước tiên kiểm tra dung dịch trắng, sau đó kiểm tra trực tiếp protein. Do có tạp chất trong dung dịch đệm, thông thường cần phải loại bỏ thông tin “nền” ở 320 nm bằng cách đặt chức năng này thành “bật”. Tương tự như xét nghiệm axit nucleic, giá trị hấp thụ ở A280 phải lớn hơn ít nhất 0,1 A, với phạm vi tuyến tính tối ưu từ 1,0 đến 1,5. Khi sử dụng công thức Warburg để hiển thị nồng độ mẫu trong thí nghiệm, đã quan sát thấy hiện tượng “trôi” trong kết quả đo. Đây là hiện tượng bình thường. Trên thực tế, miễn là sự thay đổi giá trị hấp thụ ở A280 không vượt quá 1%, kết quả sẽ rất ổn định. Sự sai lệch này là do công thức Warburg chuyển đổi giá trị độ hấp thụ thành nồng độ bằng cách nhân nó với một hệ số nhất định. Ngay cả một thay đổi nhỏ về độ hấp thụ cũng sẽ khuếch đại nồng độ, khiến kết quả có vẻ không ổn định. Phương pháp định lượng protein trực tiếp này phù hợp để kiểm tra các protein tương đối tinh khiết với thành phần tương đối đơn giản. So với các phương pháp đo màu, định lượng UV trực tiếp nhanh hơn và đơn giản hơn; tuy nhiên, nó dễ bị ảnh hưởng bởi các chất song song, chẳng hạn như DNA; nó cũng có độ nhạy thấp hơn và yêu cầu nồng độ protein cao hơn.
Định lượng Protein bằng phương pháp đo màu: Protein thường là hỗn hợp của nhiều protein. Xác định bằng phương pháp đo màu dựa trên phản ứng của các thành phần protein—axit amin (như tyrosine và serine)—với các nhóm sinh màu hoặc thuốc nhuộm được thêm vào để tạo ra chất có màu. Nồng độ của chất có màu liên quan trực tiếp đến số lượng axit amin phản ứng với protein, do đó phản ánh nồng độ protein.
Phương pháp đo màu:
Các phương pháp phổ biến bao gồm phương pháp BCA, Bradford và Lowry.
- ✓Phương pháp Lowry: Dựa trên phản ứng Biuret trước đó, nhưng có một số cải tiến. Protein phản ứng với Cu2+ tạo ra chất phản ứng màu xanh lam. Tuy nhiên, so với Biuret, phương pháp Lowry nhạy hơn. Nhược điểm bao gồm việc phải thêm nhiều thuốc thử khác nhau theo trình tự; thời gian phản ứng dài hơn; dễ bị ảnh hưởng bởi các chất không phải protein; và không phù hợp với các protein chứa EDTA, Triton X-100, amoniac sulfat, v.v.
- ✓BCA (Xét nghiệm axit bicinchoninine): Đây là một xét nghiệm protein mới hơn và nhạy hơn. Protein cần phân tích phản ứng với Cu2+ trong dung dịch kiềm để tạo ra Cu2+, sau đó tạo thành chelate với BCA, tạo thành hợp chất màu tím với đỉnh hấp thụ ở 562 nm. Hợp chất này thể hiện mối quan hệ tuyến tính mạnh với nồng độ protein, và hợp chất thu được rất bền. So với phương pháp Lowry, phương pháp này vận hành đơn giản hơn và nhạy hơn. Tuy nhiên, tương tự như phương pháp Lowry, phương pháp này dễ bị ảnh hưởng bởi protein và chất tẩy rửa.
- ✓Phương pháp Bradford: Phương pháp này hoạt động bằng cách cho protein phản ứng với Coomassie Brilliant Blue, tạo ra hợp chất màu với đỉnh hấp thụ ở 595 nm. Ưu điểm chính của phương pháp này là độ nhạy cao (gấp đôi so với phương pháp Lowry và BCA), vận hành đơn giản và nhanh hơn, chỉ cần một thuốc thử, hợp chất ổn định trong tối đa một giờ cho kết quả thuận tiện, và tương thích với nhiều chất khử ảnh hưởng đến phản ứng Lowry và BCA (như DTT và mercaptoethanol). Tuy nhiên, phương pháp này vẫn nhạy cảm với chất tẩy rửa. Nhược điểm chính là các chuẩn khác nhau có thể dẫn đến sự khác biệt đáng kể về kết quả cho cùng một mẫu, khiến chúng không thể so sánh được.
Một số nhà nghiên cứu mới làm quen với các xét nghiệm màu có thể bối rối trước kết quả không nhất quán từ các phương pháp màu khác nhau, không biết nên tin tưởng phương pháp nào. Do các phương pháp khác nhau phản ứng với các nhóm chức năng và nhóm sinh màu khác nhau, nên nồng độ thu được khi sử dụng đồng thời nhiều phương pháp trên cùng một mẫu là không thể so sánh được. Ví dụ, Keller và cộng sự đã thử nghiệm protein trong sữa mẹ và phương pháp Lowry cho thấy nồng độ cao hơn đáng kể so với phương pháp Bradford. Ngay cả khi thử nghiệm cùng một mẫu, các mẫu chuẩn khác nhau được sử dụng cho cùng một phương pháp màu sẽ cho kết quả nồng độ khác nhau. Ví dụ, khi sử dụng phương pháp Lowry để kiểm tra protein trong dịch đồng nhất tế bào, BSA làm chuẩn cho nồng độ 1,34 mg/ml, trong khi alpha globulin làm chuẩn cho nồng độ 2,64 mg/ml. Do đó, trước khi chọn phương pháp đo màu, tốt nhất nên tham khảo thành phần hóa học của mẫu cần kiểm tra và tìm một protein chuẩn có thành phần hóa học tương tự. Hơn nữa, một vấn đề thường gặp với định lượng protein bằng phương pháp đo màu là độ hấp thụ của mẫu quá thấp, dẫn đến sự chênh lệch lớn giữa nồng độ đo được và nồng độ thực tế. Một vấn đề quan trọng là màu của cuvet, một thành phần quan trọng của máy quang phổ 1011, có chu kỳ bán hủy hạn chế sau phản ứng. Do đó, mỗi phương pháp đo màu đều quy định thời gian thử phản ứng và tất cả các mẫu (bao gồm cả mẫu chuẩn) phải được thử trong khung thời gian này. Thời gian quá dài dẫn đến giá trị độ hấp thụ thấp hơn và nồng độ giảm. Ngoài ra, nhiệt độ phản ứng và độ pH của dung dịch cũng là những yếu tố quan trọng ảnh hưởng đến thí nghiệm. Hơn nữa, việc sử dụng cuvet nhựa là vô cùng quan trọng. Tránh sử dụng cuvet thạch anh hoặc thủy tinh, vì màu sau phản ứng sẽ làm ố thạch anh hoặc thủy tinh, dẫn đến giá trị hấp thụ không chính xác.
Mật độ tế bào vi khuẩn (OD 600) trong phòng thí nghiệm, việc xác định mật độ tăng trưởng và pha tăng trưởng của vi khuẩn thường dựa vào kinh nghiệm và ước lượng bằng mắt thường. Đối với các thí nghiệm đòi hỏi độ chính xác cao hơn, cần có máy quang phổ để đo chính xác mật độ tế bào vi khuẩn. OD 600 là phương pháp tiêu chuẩn để theo dõi sự phát triển của vi khuẩn trong môi trường nuôi cấy lỏng. Một dung dịch trắng được sử dụng, sau đó ủ định lượng môi trường nuôi cấy có chứa vi khuẩn. Để đảm bảo hoạt động chính xác, phải thực hiện đếm tế bào dưới kính hiển vi cho từng vi sinh vật và từng thiết bị, đồng thời phải tạo đường cong hiệu chuẩn. Đôi khi, giá trị OD âm có thể xuất hiện trong huyền phù vi khuẩn trong quá trình thí nghiệm. Điều này là do sử dụng môi trường nuôi cấy sinh màu; sau khi vi khuẩn được nuôi cấy một thời gian, chúng phản ứng với môi trường, dẫn đến sự thay đổi màu sắc. Ngoài ra, điều quan trọng cần lưu ý là không được ly tâm các mẫu thử nghiệm; vi khuẩn phải được giữ ở dạng huyền phù.
 |
Một phụ kiện quan trọng cho máy quang phổ là cuvet.
Cuvet được phân loại rộng rãi theo vật liệu thành cuvet thạch anh, cuvet thủy tinh và cuvet nhựa. Tùy thuộc vào thể tích đo, có cuvet và cuvet mao quản, v.v. Cuvet thạch anh hoặc cuvet thủy tinh thường được sử dụng để kiểm tra axit nucleic và protein định lượng UV, nhưng chúng không phù hợp cho các phép xác định màu. Do thuốc nhuộm được sử dụng trong phản ứng (chẳng hạn như Coomassie Brilliant Blue) có thể làm ố thạch anh và thủy tinh, nên phải sử dụng cuvet nhựa dùng một lần. Cuvet nhựa thường không phù hợp để kiểm tra các mẫu trong dải UV.
Do thể tích mẫu thay đổi, các nhà sản xuất máy quang phổ thường cung cấp các cuvet có thể tích khác nhau để đáp ứng các nhu cầu khác nhau của người dùng. Một loại cuvet nhựa mới, chẳng hạn như cuvet nhựa Eppendorf UVette®, đã có mặt trên thị trường. Nó có thể được sử dụng cho cả định lượng axit nucleic và protein UV, cũng như các xét nghiệm đo màu protein. Thiết bị này chỉ cần 50 μl mẫu, được đóng gói vô trùng riêng lẻ và cho phép tái chế mẫu. Cuvet này đại diện cho một cải tiến mang tính cách mạng trên thị trường cuvet. Với sự phát triển của khoa học sự sống và các ngành liên quan, nhu cầu nghiên cứu thực nghiệm trong các lĩnh vực này ngày càng cao. Máy quang phổ đang trở thành thiết bị không thể thiếu trong các phòng thí nghiệm sinh học phân tử và là thiết bị thiết yếu trong các phòng thí nghiệm vi sinh, khoa học thực phẩm và dược phẩm.
Tuy nhiên, với những tiến bộ công nghệ, cuvet không còn là thiết bị bắt buộc khi sử dụng máy quang phổ nữa. Máy quang phổ ND1000, do Nanodrop sản xuất (nay đã được Thermo Fisher Scientific mua lại), mang đến những cải tiến đáng kể so với các máy quang phổ cũ. Thiết bị này loại bỏ nhu cầu pha loãng mẫu và cuvet, chỉ cần 1-2 μl mẫu cho mỗi lần đo.
Phương pháp vận hành
- 1. Kết nối nguồn điện, bật công tắc thiết bị, mở nắp buồng tối của buồng mẫu và làm nóng trước trong 10 phút.
- 2. Điều chỉnh công tắc độ nhạy về “1” (nếu không thể điều chỉnh bộ điều chỉnh điểm không về “0”, cần cài đặt cao hơn.)
- 3. Xoay núm chọn bước sóng theo bước sóng mong muốn.
- 4. Đổ dung dịch trắng và dung dịch thử vào cuvet đầy 3/4, lau sạch thành ngoài bằng giấy lau kính, đặt chúng vào buồng mẫu và căn chỉnh ống nghiệm với đường đi của ánh sáng.
- 5. Mở nắp buồng tối, điều chỉnh bộ điều chỉnh điểm không cho đến khi kim đồng hồ chỉ số chỉ đến t=0.
- 6. Đóng nắp buồng tối, điều chỉnh bộ điều chỉnh “100” để đặt ống nghiệm vào điểm t=100. Sau khi kim đồng hồ ổn định, từ từ kéo lam kính ra, đọc giá trị mật độ quang của ống nghiệm và ghi lại.
- 7. Sau khi phân tích màu, hãy tắt nguồn, lấy cuvet ra và rửa sạch, sau đó lau sạch buồng mẫu bằng vải mềm hoặc giấy.
Lưu ý:
- 1. Trong quá trình sử dụng, nên đặt thiết bị này ở nơi khô ráo, trên bàn làm việc chắc chắn và ổn định. Ánh sáng trong nhà không nên quá mạnh. Trong thời tiết nóng, không thổi quạt trực tiếp vào thiết bị để tránh bóng đèn không sáng ổn định.
- 2. Trước khi sử dụng thiết bị này, người dùng cần hiểu rõ cấu trúc và nguyên lý hoạt động của thiết bị, cũng như chức năng của từng núm điều khiển. Trước khi bật nguồn, cần kiểm tra hiệu suất an toàn của thiết bị. Kết nối nguồn phải chắc chắn, nguồn điện phải tốt và vị trí bắt đầu của từng núm điều chỉnh phải chính xác trước khi bật công tắc nguồn.
- 3. Khi thiết bị chưa được bật nguồn, kim đồng hồ phải ở vị trí “0”. Nếu không, có thể điều chỉnh bằng vít hiệu chuẩn trên đồng hồ.
Bảo trì hàng ngày
Người sử dụng thiết bị phân tích cần nắm rõ quy trình bảo trì thiết bị hàng ngày và các phương pháp kiểm tra đơn giản đối với các chỉ số kỹ thuật chính. Họ nên thường xuyên bảo trì và kiểm tra thiết bị để đảm bảo thiết bị hoạt động ở điều kiện tối ưu.
- I. Nhiệt độ và độ ẩm là những yếu tố quan trọng ảnh hưởng đến hiệu suất của thiết bị. Những chất này có thể gây ăn mòn các bộ phận cơ khí, làm giảm độ nhẵn của gương kim loại và dẫn đến sai số hoặc suy giảm hiệu suất của các bộ phận cơ khí. Chúng cũng có thể gây ăn mòn lớp phủ nhôm trên các bộ phận quang học như lưới, gương và thấu kính hội tụ, dẫn đến công suất phát sáng không đủ, ánh sáng lạc, tiếng ồn và thậm chí là trục trặc thiết bị, do đó ảnh hưởng đến tuổi thọ của thiết bị. Cần hiệu chuẩn thường xuyên trong quá trình bảo trì. Phòng thiết bị được kiểm soát độ ẩm quanh năm với thiết bị kiểm soát nhiệt độ là điều cần thiết, đặc biệt đối với các phòng thí nghiệm ở khu vực phía Nam.
- II. Thứ hai, bụi và khí ăn mòn trong môi trường cũng có thể ảnh hưởng đến tính linh hoạt của hệ thống cơ khí, làm giảm độ tin cậy của các công tắc hành trình, nút bấm và bộ ghép quang, đồng thời cũng là nguyên nhân gây ăn mòn lớp phủ nhôm trong các bộ phận cơ khí. Do đó, cần vệ sinh thường xuyên để đảm bảo môi trường và phòng thiết bị sạch sẽ, không bụi.
- III. Sau một thời gian sử dụng, một lượng bụi nhất định sẽ tích tụ bên trong thiết bị. Tốt nhất nên nhờ kỹ sư bảo trì, hoặc dưới sự hướng dẫn của kỹ sư, định kỳ mở vỏ ngoài của thiết bị để loại bỏ bụi. Đồng thời, siết chặt lại các bộ tản nhiệt của từng bộ phận gia nhiệt, vệ sinh các cửa sổ kín của hộp quang học, hiệu chuẩn đường dẫn quang nếu cần, vệ sinh và bôi trơn các bộ phận cơ khí khi cần thiết và cuối cùng khôi phục thiết bị về trạng thái ban đầu trước khi thực hiện các thử nghiệm, điều chỉnh và ghi chép cần thiết.
 |
Bảo trì và chăm sóc
Là một thiết bị chính xác, tình trạng kỹ thuật của máy quang phổ chắc chắn sẽ thay đổi trong quá trình vận hành do nhiều yếu tố như môi trường làm việc và phương pháp vận hành. Điều này có thể ảnh hưởng đến hiệu suất của thiết bị và thậm chí gây ra hỏng hóc và tai nạn thiết bị. Do đó, các nhà phân tích phải hiểu rõ các nguyên tắc và hướng dẫn cơ bản khi sử dụng máy quang phổ, đồng thời có thể xác định và loại bỏ kịp thời những sự cố tiềm ẩn này. Việc sửa chữa kịp thời mọi trục trặc là điều cần thiết để đảm bảo thiết bị hoạt động bình thường.
- 1) Nếu bước sóng thử nghiệm thay đổi đáng kể, hãy đợi một lát để đèn đạt trạng thái cân bằng nhiệt, sau đó hiệu chuẩn lại điểm “0” và “100%” trước khi thực hiện phép đo.
- 2) Đối với các thiết bị dạng kim, kim đo phải ở vị trí số 0 khi tắt nguồn. Nếu không, cần phải hiệu chỉnh về số 0 bằng phương pháp cơ học.
- 3) Sau khi sử dụng, rửa ngay các cuvet bằng nước cất và lau sạch nước còn đọng lại bằng gạc mềm, sạch để tránh làm hỏng bề mặt và ảnh hưởng đến độ truyền qua của cuvet.
- 4) Người vận hành không nên dễ dàng di chuyển bóng đèn hoặc đèn phản xạ để tránh ảnh hưởng đến hiệu suất ánh sáng.
- 5) Máy quang phổ loại 1900 sử dụng ống nhân quang làm bộ thu quang điện. Đặc điểm vốn có của nó là hệ số khuếch đại cao, phù hợp để phát hiện các tín hiệu quang điện yếu nhưng không phát hiện được ánh sáng mạnh. Nếu không, có thể xảy ra hiện tượng trôi tín hiệu và giảm độ nhạy. Do những đặc điểm này, cần cẩn thận tránh để ống nhân quang tiếp xúc lâu với ánh sáng trong quá trình bảo trì và sử dụng. Do đó, trong quá trình làm nóng, nên mở nắp cuvet hoặc sử dụng tấm chắn sáng để tránh tiếp xúc lâu và hiện tượng trôi hiệu suất, có thể dẫn đến mất ổn định.
- 6) Sau khi thay đổi cài đặt độ nhạy của bộ khuếch đại, cần thực hiện lại việc đưa về 0.
- 7) Các vấn đề về khả năng tương thích của cuvet. Các cuvet phải được sử dụng kết hợp với nhau; nếu không, kết quả kiểm tra sẽ không có ý nghĩa. Cần so sánh trước mỗi lần kiểm tra. Phương pháp cụ thể như sau: Đổ cùng một dung dịch vào cả hai cuvet đang được kiểm tra. Đặt thiết bị ở một bước sóng cụ thể. Đối với cuvet thạch anh, đổ đầy nước cất ở bước sóng 220nm và 700nm; đối với cuvet thủy tinh, đổ đầy nước cất ở bước sóng 700nm. Điều chỉnh độ truyền qua của một cuvet thành 100% và đo độ truyền qua của các cuvet khác. Ghi lại sự chênh lệch giữa các giá trị đọc được và hướng truyền sáng. Nếu chênh lệch độ truyền qua nằm trong khoảng ±0,5%, chúng có thể được sử dụng cùng nhau. Nếu vượt quá phạm vi này, cần xem xét ảnh hưởng của nó đến kết quả thử nghiệm.
Một số lỗi điển hình dễ xảy ra trong quá trình vận hành máy quang phổ và phương pháp khắc phục sự cố:
1) Thiết bị không thể về 0. Nguyên nhân có thể:
- a) Cổng khẩu độ không thể đóng hoàn toàn. Giải pháp: Sửa chữa bộ phận cổng khẩu độ để đảm bảo nó được đóng hoàn toàn.
- b) Núm điều chỉnh độ truyền sáng bị xoay xuống dưới (“100%). Giải pháp: Điều chỉnh lại núm “100%”.
- c) Thiết bị bị ẩm quá mức. Giải pháp:
- d) Mạch bị trục trặc. Giải pháp: Gửi đến cửa hàng sửa chữa để kiểm tra mạch.
2) Thiết bị không thể đặt ở mức “100%”. Nguyên nhân có thể:
- a) Năng lượng ánh sáng không đủ. Giải pháp: Tăng phạm vi độ nhạy hoặc thay thế nguồn sáng (ngay cả khi đèn vẫn sáng).
- b) Giá đỡ cuvet không đúng vị trí. Giải pháp: Điều chỉnh giá đỡ cuvet về vị trí chính xác.
- c) Linh kiện chuyển đổi quang điện bị lão hóa. Giải pháp: Thay thế linh kiện.
- d) Mạch bị trục trặc. Giải pháp: Sửa chữa mạch.
3) Điểm “100%” thường xuyên thay đổi trong quá trình đo. Nguyên nhân có thể:
- a) Vị trí đặt cuvet không đồng đều trong giá đỡ cuvet, hoặc có giọt chất lỏng trên bề mặt cuvet. Giải pháp: Lau sạch bề mặt cuvet bằng giấy lau kính, sau đó đặt nó lên phía bên trái của giá đỡ cuvet và định vị nó theo hướng dẫn định vị. kẹp.
- b) Mạch điện bị trục trặc (điện áp, bộ thu quang điện, mạch khuếch đại). Giải pháp: Gửi đi sửa chữa. 4) Màn hình kỹ thuật số không ổn định. Nguyên nhân có thể:
- a) Thời gian khởi động không đủ. Giải pháp: Kéo dài thời gian khởi động lên khoảng 30 phút (một số thiết bị có thể trở nên không ổn định sau thời gian dài sử dụng do lão hóa).
- b) Chất hút ẩm trong ống quang điện bị hỏng, khiến hơi ẩm xâm nhập vào bộ khuếch đại dòng điện vi mô. Giải pháp: Nướng mạch và thay thế hoặc nướng chất hút ẩm.
- c) Rung động môi trường quá mức, luồng không khí mạnh gần nguồn sáng hoặc ánh sáng bên ngoài mạnh. Giải pháp: Cải thiện môi trường làm việc.
- d) Các nguyên nhân khác liên quan đến ống quang điện, mạch điện, v.v. Giải pháp: Gửi đi sửa chữa.


















Đánh giá
Chưa có đánh giá nào.